文獻標識碼: A
文章編號: 0258-7998(2015)05-0073-04
0 引言
電阻抗斷層成像(Electrical Impedance Tomography,EIT)是繼形態、結構成像之后出現的新一代無損傷醫學成像技術。根據生物組織的電阻抗特性,通過在生物體表面施加安全電流(電壓),測量其表面電壓,以所測信號為信息由計算機根據相應的電學斷層圖像重建算法得出被測對象的電阻抗分布圖像[1-3]。由于電阻抗斷層成像技術不使用超聲、射線、電磁波等技術,所以對人體無傷害,并且可以多次不間斷測量和重復使用,成本低廉,成為一種理想的無損傷醫學成像技術。EIT技術在國外的發展較早,許多研究小組都根據自己的需求開發了自己獨特的硬件系統。較為成熟的硬件系統如:美國達特茅斯小組利用DSP和FPGA構建的64通道的EIT系統[4],該系統由一個DSP主控和8個相同的從控模塊通過SPI通信,每個從控模塊都由DSP和FPGA控制4個通道的激勵、測量和校準模式;加拿大蒙特利爾小組基于無線電通信信號處理器的多頻EIT系統[5],該系統由一個掃描頭和一個基站構成,其中掃描頭包含一組16電極陣列用于測量阻抗的前端電路,基站包含16個DDS、32個數字下變頻器、數控電路控制采集序列和1個USB2.0微控制器;芬蘭的庫奧皮奧小組構建了一套基于PXI的三維電阻抗成像系統[6],該系統由16個獨立的激勵源通道和80個獨立的測量通道構成;GOHARIAN M,SOLEIMANI M等利用DSP構建的三維多頻電阻抗系統[7],該系統由48個電極構成,激勵頻率從0.1 kHz~125 kHz可調節,基于相敏解調的幅值及相位的提取方法。上述硬件系統雖然整體性能不錯,功能各有特點,但硬件結構比較復雜且成本較高,這對EIT的廣泛應用和研究帶來了一定的約束性。
本系統采用相對簡單的軟硬件設計,同樣實現了復雜的功能,工作性能穩定且成像結果清晰、準確,為醫學臨床應用監護病人肺呼吸和幫助醫生做出正確診斷提供了一種硬件設計方案。
1 硬件電路設計
系統以FPGA作為主控器,配合高速D/A轉換器,經過壓流變換產生高精度正弦電流作為激勵源,通過模擬開關依次加載到與被測物體連接的傳感器上,采用相鄰激勵相鄰測量的方式,把采集到的信號經過信號調理電路及高速A/D轉換器送入FPGA中解析出信號的幅值,再通過RS232上傳到電腦進行成像。圖1所示為EIT系統下位機的硬件電路原理框圖。
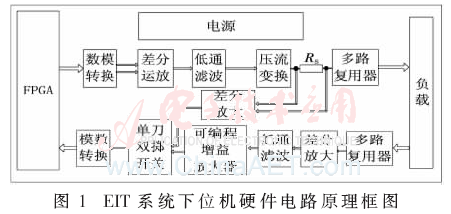
該系統下位機硬件結構的構建使用了模塊化設計理念,包括電源模塊、以FPGA為控制核心的激勵和采集模塊及多路復用器模塊,這3個模塊都裝配到一個母板上。利用LabVIEW編寫的上位機人機交互界面負責用戶指令的發送和接收上傳數據并進行實時成像。
激勵信號源的性能是影響整個系統精度的重要因素,對信號源的精度、穩定性、動態范圍及信噪比都有較高的要求。系統利用FPGA自帶的DDS(Direct Digital Synthesizer)IP核,對其進行相應的配置使其產生頻率為100 kHz、相位為0的數字正弦信號,經模數轉換和低通濾波后得到比較純凈的模擬正弦電壓。正弦電壓通過增強型的Howland電流源拓撲結構—電壓控制電流源(VCCS)[8]得到恒流源。考慮到作用對象人體所能接受的最大安全電流為5 mA,通過調節回路中的運放使得輸出電流為4 mA。在實際的電路中由于輸出雜散電容等的影響,輸出阻抗不是無窮大;在高頻下,較大的輸出電容也會使得Howland電流源正負反饋回路引起電路的振蕩。因此,根據本電路設計以并行的方式在反饋回路增加一個6.8 pF的陶瓷電容來改善這種影響[9]。
輸出的恒定正弦電流首先經過一個標準電阻(RS=10 Ω),通過差分運放取得電阻兩端的電壓差,經過單刀雙擲開關選擇通道及ADC轉換之后送入FPGA進行分析,其有兩大作用:一是通過對輸出電流進行監測,對其隨時間變化及通道切換時的穩定性進行定量分析并且計算恒流源的輸出阻抗;二是通過對輸出電流的值進行分析,對各通道電極與被測對象是否良好連接進行判斷,并且在硬件電路上有相應的4個LED指示燈進行顯示哪些通道電極處于虛連狀態。能夠直觀準確地幫助測試人員對接觸不好的電極重新連接,從而避免后期采集數據完畢后再通過算法檢測是否有電極接觸不良導致的數據錯誤。
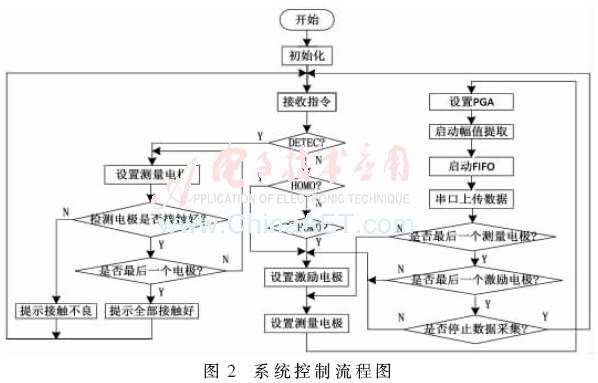
2 系統下位機軟件設計
系統主程序采用VHDL語言完成各元件信號的物理連接,利用FPGA片上嵌入的PicoBlaze微處理器完成數據采集過程的串行時序控制,具體為激勵電極的切換、測量電極的切換、PGA增益的調節、幅值提取的控制、FIFO啟動及串口收發的控制等。
利用VHDL語言設計了一個幅值提取的元件(component)實體,把測量到的數據通過幅值提取元件提取其幅值。為了最大程度地降低噪聲干擾又兼顧速度平衡,對每一個測量點采用連續采集5個周期的幅值,去掉最大值和最小值后利用算數平均法得到這一個測量點的最終幅值。
系統軟件控制流程如圖2所示。具體的控制流程為:當利用LabVIEW編寫的上位機人機交互界面準備就緒后,首先檢測所有電極是否接觸良好,并發送“DETEC”指令,目的是檢測電極是否接觸良好。當有電極接觸不好,程序會暫停并上傳bad connect,同時核心板上與通道檢測有關的的4個指示燈會按二進制編碼的方式亮起來指示哪個通道沒有接觸好。操作人員重新連接該通道后重新循環檢測,直到檢測所有通道接觸良好;然后發送“HOMO”,目的是采集一幅均勻場的數據。采集完畢后通過串口上傳到上位機并預先存入LabVIEW的數據庫作為成像時的參考數據。最后發送“INHOMO”,目的是采集非均勻場數據,一直采集直至接收到停止指令。每采集完一幅圖像的完整數據后調用MATLAB程序利用共軛梯度算法進行成像。
3 系統性能及模型試驗
3.1 系統信噪比測試
在試驗圓桶上進行連續100次的空場數據采集,用式(1)計算系統中各通道的信噪比SNR,其中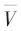 是每個通道100次的平均電壓,Vi是每個通道第i次測量電壓,L=100是測量次數。經測試各通道的最大值為59.32 dB,平均值為45.88 dB。
是每個通道100次的平均電壓,Vi是每個通道第i次測量電壓,L=100是測量次數。經測試各通道的最大值為59.32 dB,平均值為45.88 dB。
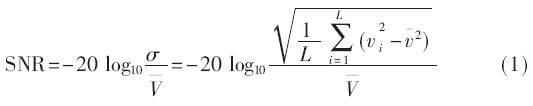
3.2 物理模型動態性能測試
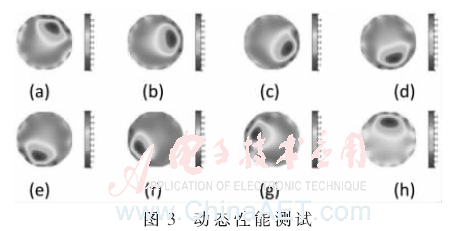
在試驗鹽水槽中,直徑為30 mm的有機玻璃棒在L=10 mm處,電極2和電極3處開始以大約8 r/s的速度按順時針方向勻速轉動一周。其動態成像結果如圖3,通過這8幅圖像基本可以反映有機玻璃棒的運動過程,表明該系統能夠對運動的物體進行準確識別。
4 人體肺呼吸成像實驗
4.1 呼吸過程數據采集
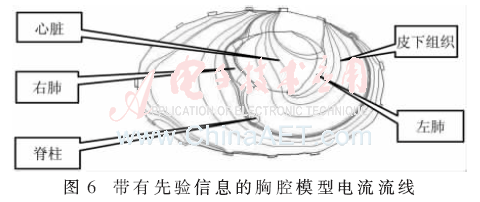
在實驗室環境溫度為21 ℃,待測志愿者(男性)胸部周邊沿著第5肋骨與第6肋骨之間均勻粘貼16個一次性心電電極。具體做法如下:首先用軟尺標出16個電極的位置使1號電極粘貼在右側腋窩下,其他電極依次向左側粘貼,6、7號電極恰好位于心臟區域,9號電極在左側腋窩下,13~14 電極在后背的脊柱左右。在要粘貼心電極部位皮膚擦拭酒精,然后按照標記水平粘貼16個心電電極。心電電極與人體皮膚接觸(粘貼)部分中起導電性的為導電壓敏膠。
測試時,把數據采集系統通過專用導聯線連接到粘貼在人體胸腔處的一次性心電極,待測者坐立,采用幅值為4.5 mA、頻率為100 kHz的正弦激勵電流進行相鄰激勵,并用相鄰測量模式采集邊界電壓,采集速度為1 r/s。開始采集時肺部處于呼吸末狀態并將其作為參考數據,然后進行連續深呼吸,系統實時采集數據并通過串口通信上傳到上位機。
4.2 圖像重建
將人體CT圖像中提取的胸腔外圍輪廓導入到仿真軟件Comsol Multiphysics中建立起16電極的胸腔模型,進行正問題求解后導入MATLAB 計算得到靈敏度系數矩陣,再利用共軛梯度算法重建 EIT 圖像。由于不同的組織具有不同的電阻抗頻率特性,為人體胸腔內部肺呼吸的圖像重建提供了非常有價值的先驗信息,這些先驗信息能夠使正問題的求解更好地接近實際情況,進而在求解逆問題圖像重建時得到更加真實的成像效果。其中胸腔模型中是否加入先驗信息對于成像質量的影響比較大,下文將對沒有加入先驗信息的均勻胸腔模型和加入了先驗信息的胸腔模型進行成像試驗對比。
4.2.1 均勻胸腔模型成像試驗
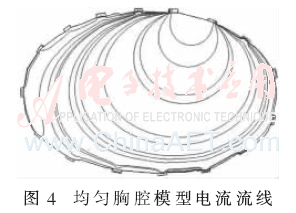
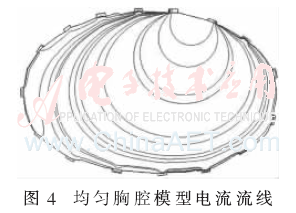
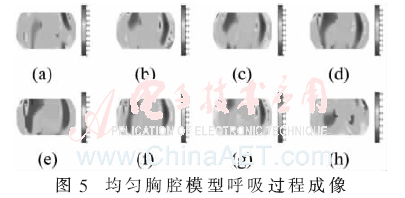
首先假設胸腔內部是均勻場,即各處電導率相同,沒有區分肺部、心臟、脊椎和皮下組織,其電導率均設為皮下組織的電導率0.037 Ω/m,經過正問題求解得到如圖4所示的電流流線圖,將其導入到MATLAB后計算得到靈敏度系數矩陣,再利用本EIT系統采集到的人體呼吸時的邊界電壓信息進行圖像重建,其中一個呼吸過程的成像結果如圖5所示。其中圖(a)~圖(e)是逐漸吸氣至最大吸氣量過程中肺部阻抗分布圖像,圖(f)~圖(h)是呼氣至殘氣量的阻抗分布圖像。
4.2.2 帶有先驗信息的胸腔模型成像試驗
本設計結合了先驗信息,在胸腔模型中加入皮下組織、肺、心臟及脊椎的電導率,經過正問題求解得到圖6所示的電流流線圖。
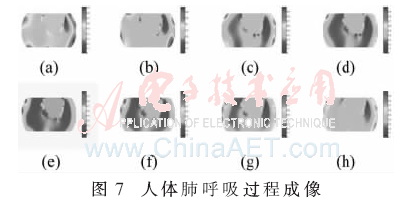
將其導入到MATLAB后計算得到靈敏度系數矩陣,再利用采集到的呼吸過程的數據進行成像,其中一個呼吸過程的成像結果如圖7所示,其中圖(a)~圖(e)是逐漸吸氣至最大吸氣量過程中肺部阻抗分布圖像,圖(f)~圖(h)是呼氣至殘氣量的阻抗分布圖像。
5 結論
經過對比均勻胸腔模型和帶有先驗信息的胸腔模型成像結果試驗,最終利用帶有先驗信息的胸腔模型經過正逆問題求解后得到了清晰的肺部輪廓變化的成像。結果表明該系統能夠實時監測到人體肺呼吸的過程變化,為深入開展肺功能評價研究及呼吸過程的床旁監護等需求奠定了可靠有效的硬件基礎。
參考文獻
[1] BARBER D C,BROWN B H.Information processing in medical imaging:recent development in applied potential tomography—APT[M].Bacharach S L ed.Nijhoff,1986:106-121.
[2] BROWN B H.Electrical impedance tomography(EIT):A review[J].Med Eng Technol,2003,27(3):97-108.
[3] Chen Xiaoyan,Wang Huaxiang.Lung ventilation functional monitoring based on electrical impedance tomography.Trans.Tianjin Univ.,2009,15:007-012.
[4] HALTER R J,HARTOV A,PAULSEN K D.A broadband high-frequency electrical impedance tomography system for breast imaging[J].IEEE Trans Biomed Eng,2008,55(2):650-659.
[5] ROBITAILLE N,GUARDO R.A multifrequency EIT system design based on telecommunication signal processors[J].IOP PUBLISHING,Physiol.Meas,2009,30:S57-S71.
[6] KOURUNEN J,SAVOLAINEN T.Suitability of a PXI platform for an electrical impedance tomography system[J].IOP PUBLISHING Meas.Sci.Technol,2009,20:015503.
[7] GOHARIAN M,SOLEIMANI M.A DSP based multi-fre-quency 3D electrical impedance tomography system[J].Annals of Biomedical Engineering,2008,36(9):1594-1603.
[8] Bertemes-Filho,P.B.H.Brown,A.J.Wilson.A comparison of modified howland circuits as current generators with current mirror type circuits[J].Physiol Meas,2000,21:1-6.
[9] COOK R D,SAUNIER G J,GISSER D G,et al.ACT3:a high-speed, high-precision electrical impedance tomograph[J].IEEE Trans.Biomed.Eng.1994,41:713-722.

